Docuply
Das elektronische Qualitätsmanagementsystem für pharmazeutische KMU und Start-Ups. Vorvalidiert, sofort einsatzbereit und mit sicherem Hosting in der EU-Cloud. Das Resultat: Nie wieder Stress mit Audits und Inspektionen.

Als maßgeschneidertes elektronisches Qualitätsmanagementsystem (eQMS) für kleine und mittelständische pharmazeutische Unternehmen bietet Docuply die ideale Lösung für folgende Unternehmenstypen:
Pharmazeutische Start-Ups & Scale-Ups
Docuply bietet pharmazeutischen Start-Ups und Scale-Ups ein sofort einsatzbereites, vorvalidiertes eQMS mit attraktivem Pricing. Die intuitive Benutzeroberfläche erfordert kein langes Training, und das Training Hub erleichtert das Onboarding neuer Mitarbeiter – ideal für schnelles Wachstum.
Contract Research Organisations
Docuply optimiert das Qualitäts- und Datenmanagement für Contract Research Oganisations (CRO) und gewährleistet Audit Readiness. Das TMF-Feature (CDISC-Referenzmodell) gibt Sponsoren jederzeit Einblick in den Studienfortschritt, während das reibungslose Einladen von Site-Benutzern und 21 CFR Part 11-konforme Signaturen die tägliche Arbeit vereinfachen.
Pharmazeutische Dienstleister
Mit Docuply optimieren pharmazeutische Dienstleister wie Reinraumreinigungs- und Logistikdienstleister ihr Schulungsmanagement. Das Training Hub sorgt für effiziente Schulungen und die Schulungsmatrix stellt die lückenlose Nachweispflicht sicher. Eigene Auditaufwände werden somit auf ein Minimum reduziert – die Kundenzufriedenheit steigt nachhaltig.
Unsere Mission
Mit Docuply ermöglichen wir Pharma- und Biotechunternehmen ein reibungsloses und sicheres Qualitätsmanagement mit Third Parties und verteilten Teams. So vermeiden Sie chaotische Audits und Stillstand während einer Inspektion. Letztendlich bleibt so mehr Zeit für das Wesentliche: Die Welt mit neuen Arzneimitteln ein Stückchen besser machen.

Digitalisieren und automatisieren Sie Ihre täglichen QM-Aufgaben mit Docuply und profitieren Sie von integrierten KI-Funktionalitäten, die Ihre Aufgaben um bis zu 80% beschleunigen.
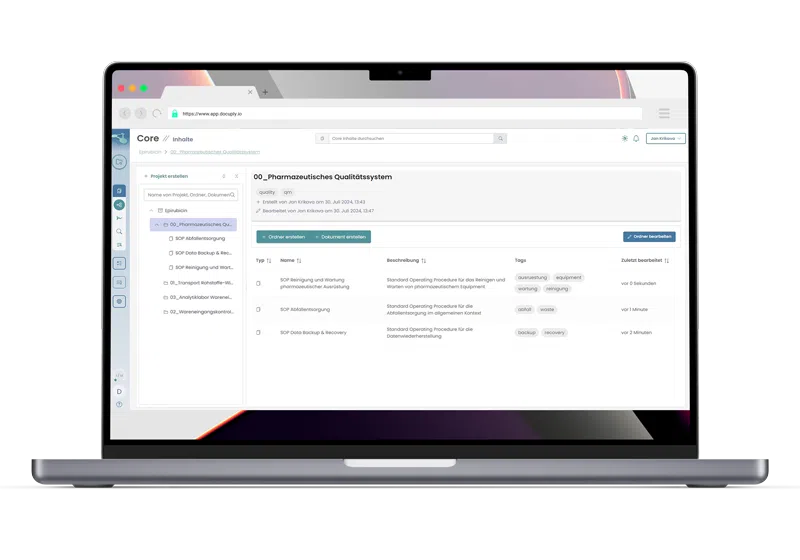
Konformes Dokumentenmanagement, blitzschnell dank Cloud-Technologie.
Alle Features auf einen Blick
- Setup und Onboarding in zehn Minuten
- Vorvalidiertes System (IQ & OQ) für den sofortigen Einsatz
- EU Cloud mit 99,95+% Verfügbarkeit
- Zertifiziert nach ISO27001 und DSGVO-konform
- GLP-, GCP- und GMP-konformes Dokumentenmanagement
- Digitale Signatur nach 21 CFR Part 11 und Annex 11
- Audit Trail in der Private Blockchain
- Einfaches Einladen von Third Parties und externen Benutzern
- Moderne Verschlüsselung aller hochgeladenen Dokumente
- Unterstützung von allen gängigen Dokumententypen
- Texterkennung (OCR) für viele Dokumententypen
- Trial Master Files mit CDISC-Referenzmodell
- Zentrales Verwalten von SOP-Trainings und anderen Schulungen
- Einfacheres Finden Ihrer Dokumente mit Hilfe von Tags
- Schnittstellen für die nahtlose Integration in Ihre IT-Landschaft (in naher Zukunft)
- Weitere zukünftige Features finden Sie auf unserer Product Roadmap

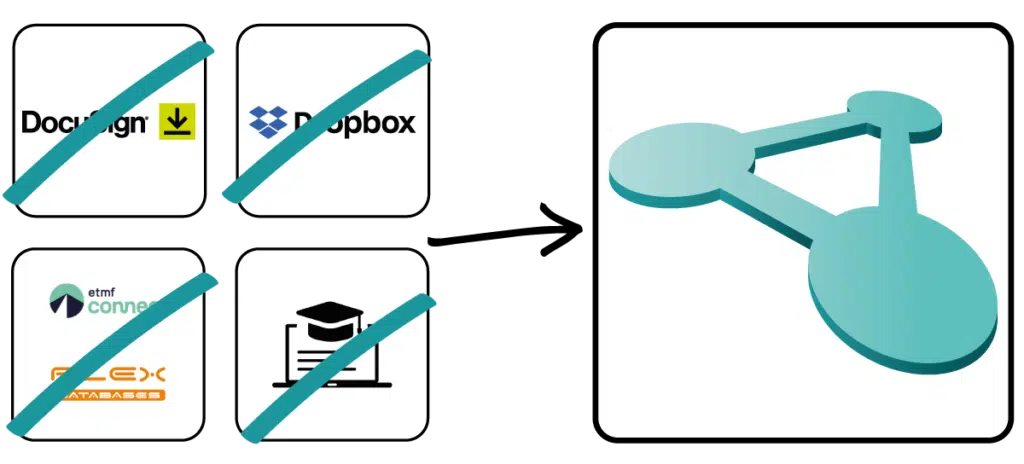
Verlassen Sie sich nicht auf Insellösungen für Ihr Qualitätsmanagement und nutzen Sie mit Docuply eine voll integrierte Lösung ohne lästiges Hin- und Herspringen zwischen verschiedenen Anwendungen.
Was Experten über uns sagen
Bekannt aus


















Kostenloses Dokumentenmanagement für Start-Ups
Bis zu 8 Benutzer, bis zu 500 MB und 10 elektronische Signaturen (21 CFR Part 11-konform) pro Monat sind bedingungslos kostenlos. So vermeiden Sie SharePoint-Patchwork und nutzen mit Docuply eine einfach validierbare Lösung.

Kontaktformular
Sie haben Fragen oder Anregungen? Wir stehen Ihnen gerne zur Verfügung.



