Wann ist GxP im Sinne von GLP, GCP und GMP für mein Unternehmen regulatorisch relevant?

Good Practices (GxP) sind eine Reihe von Vorschriften und Richtlinien, die von Aufsichtsbehörden wie der U.S. Food and Drug Administration (FDA) und der European Medicines Agency (EMA) aufgestellt wurden, um die Qualität und Sicherheit von Pharmazeutika und Biotechnologieprodukten zu gewährleisten.
In der pharmazeutischen und biotechnologischen Industrie sollte GxP über den gesamten Produktlebenszyklus hinweg umgesetzt werden, von der Forschung und Entwicklung über die Herstellung und Prüfung bis hin zum Vertrieb. Dies umfasst die folgenden Phasen:
- Forschung und Entwicklung: In der F&E-Phase sollten die GxP-Grundsätze befolgt werden, um sicherzustellen, dass die Entwicklung neuer Arzneimittel und biotechnologischer Produkte auf wissenschaftlich strenge, ethische und gut dokumentierte Weise erfolgt. Dazu gehören die Planung klinischer Prüfungen, die Auswahl der Prüfstellen, die Erhebung und Verarbeitung klinischer Daten und die Berichterstattung über die Prüfergebnisse. Klinische Prüfungen sollten beispielsweise nach den Richtlinien der Guten Klinischen Praxis (Good Clinical Practice, GCP) durchgeführt werden, um die Sicherheit der Studienteilnehmer und die Gültigkeit der Studienergebnisse zu gewährleisten.
- Herstellung: In der Herstellungsphase sollten die GxP-Vorschriften befolgt werden, um die Qualität und Konsistenz von Arzneimitteln und Biotech-Produkten zu gewährleisten. Dazu gehören die Vorschriften zur guten Herstellungspraxis (Good Manufacturing Practice, GMP), die Standards für die Planung, den Bau und den Betrieb von Herstellungsanlagen sowie für die Qualitätskontrollverfahren zur Gewährleistung der Produktqualität festlegen. Die GMP-Vorschriften regeln auch die Prüfung von Rohstoffen, Zwischenprodukten und Endprodukten, um deren Qualität und Konsistenz zu gewährleisten.
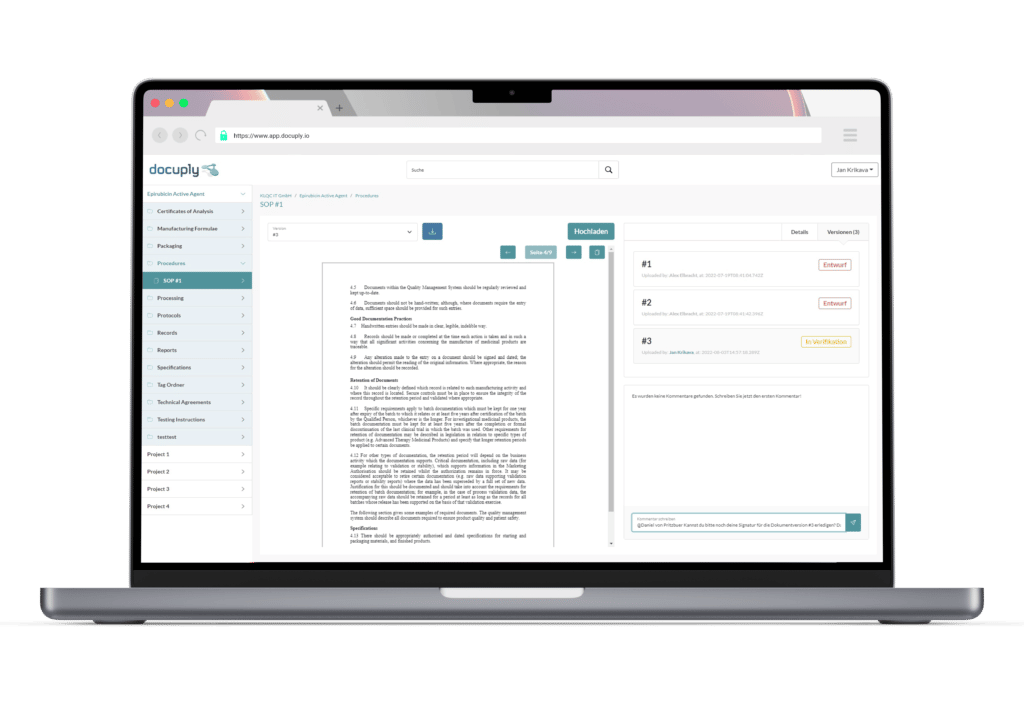
Speziell für die Pharmabranche entwickelt: GxP-konformes Dokumentenmanagement mit Docuply, einfach zu bedienen und sofort einsatzbereit.
- Prüfung: In der Testphase sollten die GxP-Grundsätze angewandt werden, um die Sicherheit und Wirksamkeit von Arzneimitteln und biotechnologischen Produkten zu gewährleisten. Dazu gehören die Vorschriften für die Gute Laborpraxis (GLP), die Standards für die Planung, Durchführung und Berichterstattung von Laborstudien festlegen, sowie die Vorschriften für die Gute Klinische Laborpraxis (GCLP), die Standards für die Durchführung von Labortests in einem klinischen Umfeld festlegen. Die GLP- und GCLP-Vorschriften stellen sicher, dass Laborstudien auf wissenschaftlich strenge, gut dokumentierte und kontrollierte Weise durchgeführt werden.
- Vertrieb: In der Vertriebsphase müssen die GxP-Vorschriften eingehalten werden, um sicherzustellen, dass Arzneimittel und Biotech-Produkte ordnungsgemäß gelagert, transportiert und gehandhabt werden, um ihre Qualität und Sicherheit zu gewährleisten. Dazu gehören die Vorschriften zur guten Vertriebspraxis (Good Distribution Practice, GDP), die Standards für die Lagerung und den Transport von Arzneimitteln und Biotech-Produkten sowie für den Umgang mit Rücksendungen und Rückrufen festlegen. Die GDP-Vorschriften stellen sicher, dass die Bedingungen, unter denen Arzneimittel und biotechnologische Produkte gelagert und transportiert werden, geeignet sind, ihre Qualität und Sicherheit zu erhalten, und dass angemessene Verfahren für den Umgang mit Rücksendungen und Rückrufen vorhanden sind.
Es ist wichtig zu wissen, dass GxP keine einmalige Implementierung ist, sondern ein kontinuierlicher Prozess, der eine laufende Überwachung und Bewertung erfordert, um die Einhaltung der Vorschriften und die Qualität während des gesamten Produktlebenszyklus sicherzustellen.
Testen Sie jetzt unverbindlich alle Vorteile eines digitalen Dokumentenmanagementsystem, das speziell für die Pharma- und Biotechbranche entwickelt wurde. In nur fünf Minuten können Sie starten, überzeugen Sie sich selbst.
Qualitätsmanagement in der Pharma- und Biotechbranche: Aktuelle Herausforderungen bei der Zusammenarbeit zwischen Pharmaunternehmen und CROs, CMOs und CDMOs
