Was bedeutet GxP?

GxP ist ein Begriff, der sich auf eine Reihe von Qualitätsrichtlinien und -vorschriften bezieht, die für Branchen wie Pharma, Biotech, Medizinprodukte und Lebensmittelproduktion gelten. Der Begriff „GxP“ ist eine Abkürzung für die verschiedenen Vorschriften, Normen und Richtlinien, wobei das „x“ für die jeweilige Phase in der Werstschöpfungskette steht, z.B. „GMP“ für Good Manufacturing Practices (Gute Herstellungspraxis), „GCP“ für Good Clinical Practices (Gute klinische Praxis), „GLP“ für Good Laboratory Practices (Gute Laborpraxis) und „GDP“ für Good Distribution Practices (Gute Vertriebspraxis).
Der Zweck der GxP ist es, sicherzustellen, dass die in diesen Branchen hergestellten Produkte sicher, wirksam und von hoher Qualität sind. Diese Vorschriften enthalten Leitlinien für alle Aspekte des Produktlebenszyklus, von der Forschung und Entwicklung über die Herstellung, Prüfung und den Vertrieb bis hin zur Überwachung nach der Markteinführung. Durch die Einhaltung von GxP können Unternehmen sicherstellen, dass ihre Produkte die gesetzlichen Anforderungen erfüllen, den Erwartungen der Kunden entsprechen und das Risiko von Produktrückrufen, Haftungsansprüchen und Rufschädigung verringern. Die Bedeutung von GxP lässt sich an den Folgen einer Nichteinhaltung verdeutlichen. Die Nichteinhaltung von GxP-Vorschriften kann zu behördlichen Maßnahmen wie Abmahnungen, Geldbußen und sogar strafrechtlicher Verfolgung führen. Die Nichteinhaltung kann auch zu Produktrückrufen führen, die teuer sind und den Ruf eines Unternehmens schädigen können. Darüber hinaus kann die Nichteinhaltung von Vorschriften zu einer Schädigung von Patienten führen, was in der Gesundheitsbranche katastrophale Folgen haben kann. Daher ist es für Unternehmen in GxP-regulierten Branchen unerlässlich, robuste Qualitätssysteme einzurichten und kontinuierlich zu verbessern, um die Einhaltung der GxP-Vorschriften zu gewährleisten. Qualitätssysteme sollten Richtlinien, Verfahren, Schulungen, Dokumentation und Audits umfassen, um sicherzustellen, dass alle Aspekte des Produktlebenszyklus kontrolliert und überwacht werden. Qualitätssysteme sollten so konzipiert sein, dass sie potenzielle Qualitätsprobleme erkennen, verhindern und abmildern, bevor sie auftreten.
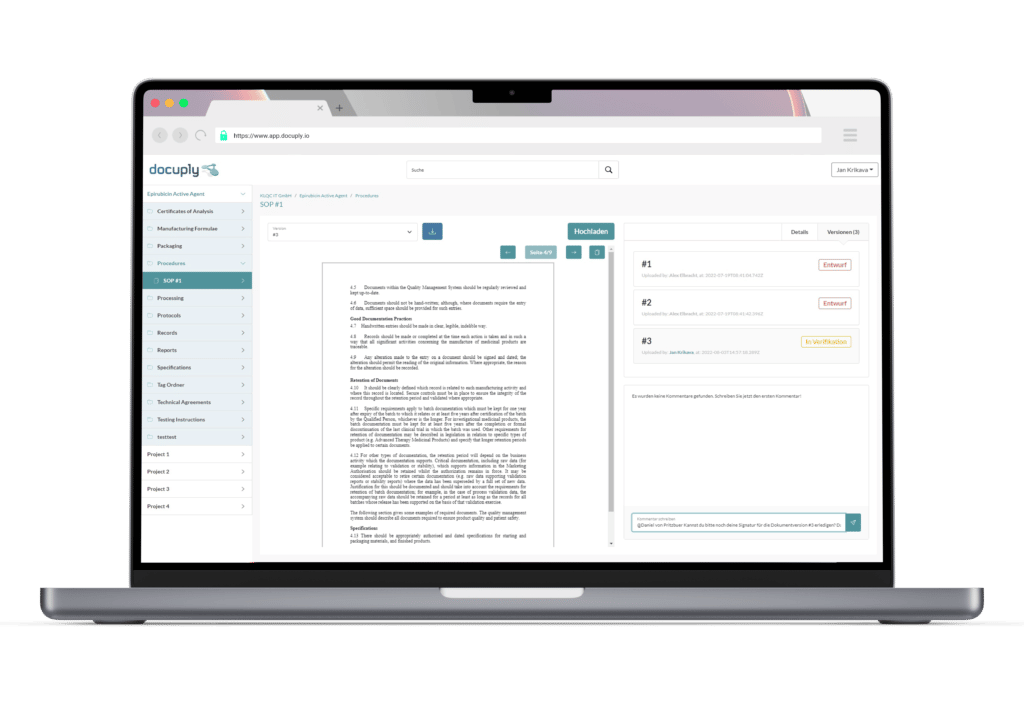
Speziell für die Pharmabranche entwickelt: GxP-konformes Dokumentenmanagement mit Docuply, einfach zu bedienen und sofort einsatzbereit.
Einige Schlüsselelemente der GxP umfassen:
- Gute Herstellungspraxis (GMP): Sicherstellung, dass alle Aspekte des Herstellungsprozesses, einschließlich Personal, Einrichtungen, Ausrüstung, Materialien und Prozesse, kontrolliert und überwacht werden, um die Produktqualität und -konsistenz zu gewährleisten.
- Gute klinische Praxis (GCP): Gewährleistung, dass klinische Versuche ethisch einwandfrei, sicher und gemäß den gesetzlichen Vorschriften durchgeführt werden.
- Gute Laborpraxis (GLP): Sicherstellung, dass alle Aspekte von Laboruntersuchungen in einer Weise geplant, durchgeführt, überwacht, aufgezeichnet, berichtet und archiviert werden, die die Integrität und Zuverlässigkeit der Daten gewährleistet.
- Gute Vertriebspraxis (GDP): Sicherstellen, dass die Produkte unter geeigneten Bedingungen transportiert und gelagert werden, um ihre Qualität und Unversehrtheit zu erhalten, und dass der gesamte Vertriebsprozess dokumentiert und kontrolliert wird.
Zusammenfassend lässt sich sagen, dass GxP-Vorschriften wichtig sind, um sicherzustellen, dass die in regulierten Branchen hergestellten Produkte sicher, wirksam und von hoher Qualität sind. Die Einhaltung der GxP-Vorschriften kann Unternehmen helfen, behördliche Maßnahmen, Produktrückrufe und Rufschädigung zu vermeiden. Unternehmen müssen robuste Qualitätssysteme einrichten und pflegen, um die Einhaltung der GxP-Vorschriften während des gesamten Produktlebenszyklus zu gewährleisten.
Testen Sie jetzt unverbindlich alle Vorteile eines digitalen Dokumentenmanagementsystem, das speziell für die Pharma- und Biotechbranche entwickelt wurde. In nur fünf Minuten können Sie starten, überzeugen Sie sich selbst.
Qualitätsmanagement in der Pharma- und Biotechbranche: Aktuelle Herausforderungen bei der Zusammenarbeit zwischen Pharmaunternehmen und CROs, CMOs und CDMOs
