Verstehen der Relevanz von FDA 21 CFR Part 11 in der Pharmaindustrie

In der sich ständig weiterentwickelnden Pharmaindustrie sind strenge Vorschriften erforderlich, um die Sicherheit der Patienten, die Produktqualität und die Genauigkeit der Daten zu gewährleisten. Eine dieser Vorschriften, FDA 21 CFR Part 11, ist von besonderer Bedeutung. In diesem Artikel werden die wichtigsten Aspekte von FDA 21 CFR Part 11 und ihre Auswirkungen auf den Pharmasektor untersucht.
Überblick über FDA 21 CFR Teil 11
FDA 21 CFR Part 11 mit dem Titel „Electronic Records; Electronic Signatures“ (Elektronische Aufzeichnungen; elektronische Signaturen) legt Richtlinien für die Verwendung elektronischer Aufzeichnungen und elektronischer Signaturen in der pharmazeutischen Industrie fest. Ziel ist es, die Authentizität, Integrität und Vertraulichkeit elektronischer Daten zu gewährleisten, die bei der Herstellung von Arzneimitteln, klinischen Versuchen und anderen regulierten Aktivitäten anfallen. Die Einhaltung von Teil 11 ist entscheidend für die Wahrung der Datengenauigkeit, die Verhinderung von Betrug und die Erfüllung der regulatorischen Erwartungen der Food and Drug Administration (FDA).
Die wichtigsten Anforderungen von FDA 21 CFR Part 11
- Elektronische Aufzeichnungen: Teil 11 schreibt vor, dass elektronische Aufzeichnungen während ihres gesamten Lebenszyklus sicher, zuverlässig und genau sein müssen. Dazu gehören Anforderungen an die elektronische Dokumentation von Herstellungsprozessen, Chargenprotokollen, Laborergebnissen und anderen wichtigen Daten.
- Elektronische Unterschriften: Teil 11 erlaubt die Verwendung elektronischer Signaturen als rechtsverbindliche Alternative zur herkömmlichen handschriftlichen Unterschrift. Es werden Richtlinien für den Einsatz kryptographischer Verfahren festgelegt, um die Authentizität und Unverfälschbarkeit elektronischer Signaturen zu gewährleisten.
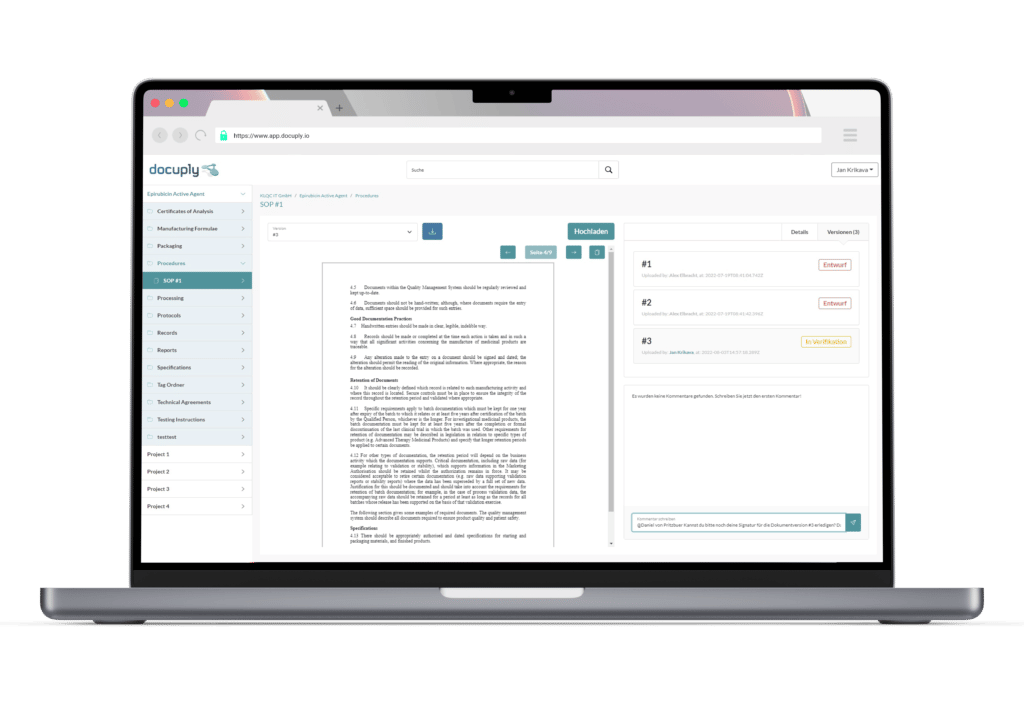
- Prüfprotokoll (Audit Trail): Teil 11 verlangt, dass Systeme über ein Prüfprotokoll (Audit Trail) verfügen, der eine chronologische Aufzeichnung aller Systemaktivitäten, einschließlich Benutzeraktionen, Datenänderungen und Systemereignisse, enthält. Diese Protokollierung hilft bei der Rückverfolgbarkeit, der Rechenschaftspflicht und der Überprüfung der Datenintegrität. Docuply als Dokumentenmanagementsystem für die Pharmaindustrie bietet von Haus aus einen Audit Trail.
Vorteile der Einhaltung
Die Einhaltung von FDA 21 CFR Part 11 bietet der pharmazeutischen Industrie mehrere Vorteile. Sie gewährleistet die Datenintegrität und verringert das Risiko von Fehlern, Manipulationen und betrügerischen Aktivitäten. Darüber hinaus wird die Patientensicherheit erhöht, da während des gesamten Prozesses der Arzneimittelentwicklung und -herstellung genaue und zuverlässige Aufzeichnungen geführt werden. Die Einhaltung der Vorschriften vereinfacht auch behördliche Inspektionen und Audits, da Unternehmen, die sich an Teil 11 halten, besser darauf vorbereitet sind, die Datengenauigkeit und die Einhaltung der behördlichen Anforderungen nachzuweisen.
Mit Docuply kommen Sie und Ihre Third Parties reibungslos und GLP-compliant von den präklinischen Studien in die klinischen Studien.
Herausforderungen bei der Umsetzung
Die Umsetzung von FDA 21 CFR Part 11 kann für Pharmaunternehmen eine Herausforderung darstellen. Unternehmen müssen in zuverlässige elektronische Systeme und Softwarelösungen investieren, die die strengen Anforderungen der Verordnung erfüllen. Darüber hinaus ist die Schulung der Mitarbeiter in Bezug auf die ordnungsgemäße Nutzung des Systems, die Datensicherheit und die Protokolle für elektronische Signaturen unerlässlich. Um die Einhaltung der Vorschriften in einer sich schnell entwickelnden technologischen Landschaft zu gewährleisten, sind außerdem regelmäßige Aktualisierungen, Systemvalidierungen und eine laufende Überwachung erforderlich.
Fazit
FDA 21 CFR Part 11 spielt eine wichtige Rolle bei der Gewährleistung von Datenintegrität, Sicherheit und Compliance in der Pharmaindustrie. Durch die Einhaltung der Anforderungen der Verordnung für elektronische Aufzeichnungen, Signaturen und Prüfpfade können Pharmaunternehmen die Sicherheit der Patienten schützen, die betriebliche Effizienz steigern und die Einhaltung der Vorschriften in einem zunehmend digitalen Zeitalter gewährleisten.
Testen Sie jetzt unverbindlich alle Vorteile eines digitalen Dokumentenmanagementsystem, das speziell für die Pharma- und Biotechbranche entwickelt wurde. In nur fünf Minuten können Sie starten, überzeugen Sie sich selbst.
Qualitätsmanagement in der Pharma- und Biotechbranche: Aktuelle Herausforderungen bei der Zusammenarbeit zwischen Pharmaunternehmen und CROs, CMOs und CDMOs
