Was ist ein Pre-IND-Meeting?

Als Pharma- oder Biotech-Startup ist einer der wichtigsten Schritte, um ein neues Medikament auf den Markt zu bringen, das Pre-IND-Meeting. Dieses Treffen, das zwischen dem Start-up und der FDA oder EMA stattfindet, ist eine Gelegenheit, das vorgeschlagene Arzneimittelentwicklungsprogramm zu besprechen und von der FDA bzw. EMA ein Feedback zum geplanten IND-Antrag zu erhalten.
Einer der wichtigsten Aspekte des Pre-IND-Meetings ist die Vorbereitung. Es ist wichtig, dass Sie mit einer gut vorbereiteten und organisierten Präsentation zu dem Treffen kommen, die Ihr geplantes Arzneimittelentwicklungsprogramm klar umreißt. Dazu gehören Informationen über Ihre präklinischen Daten, das geplante Design der klinischen Studie und Ihre Pläne für die Herstellung und Qualitätskontrolle. Für das Zusammentragen der geforderten präklinischen Daten und das Qualitätsmanagement ist ein ordentliches Dokumentenmanagement unabdingbar. Hier können elektronische Dokumentenmanagementsysteme, wie zum Beispiel Docuply helfen.
Ein weiterer wichtiger Aspekt des Pre-IND-Meetings ist die Kommunikation. Es ist wichtig, während des Treffens klar und effektiv mit der FDA bzw. der EMA zu kommunizieren und offen und transparent über Ihre Pläne und alle potenziellen Herausforderungen oder Bedenken zu sprechen. Wichtig ist auch, dass Sie den Rückmeldungen der Behörden aufmerksam zuhören und deren Kommentare und Vorschläge bei der Weiterentwicklung Ihres Arzneimittelentwicklungsprogramms berücksichtigen.
In Bezug auf das Pre-IND-Meeting sollte man ebenso die Einhaltung der gesetzlichen Vorschriften erwähnen. Die FDA und EMA haben strenge Richtlinien für IND-Anträge, und es muss unbedingt sichergestellt werden, dass Ihr vorgeschlagenes Arzneimittelentwicklungsprogramm diesen Richtlinien entspricht. Dies kann eine enge Zusammenarbeit mit Zulassungsexperten erfordern, um sicherzustellen, dass Ihre Pläne mit den Anforderungen der Behörden übereinstimmen.
Auch die Finanzierung ist für Pharma- oder Biotech-Start-ups im Zusammenhang mit dem Pre-IND-Meeting ein wichtiger Aspekt. Die Entwicklung eines neuen Medikaments kann ein kostspieliger Prozess sein, und es ist von entscheidender Bedeutung, dass Sie über ausreichende Finanzmittel verfügen, um Ihr Entwicklungsprogramm zu unterstützen. Dazu gehört auch, dass Sie den Investoren einen soliden Geschäftsplan vorlegen und den potenziellen Wert Ihres Medikaments nachweisen.
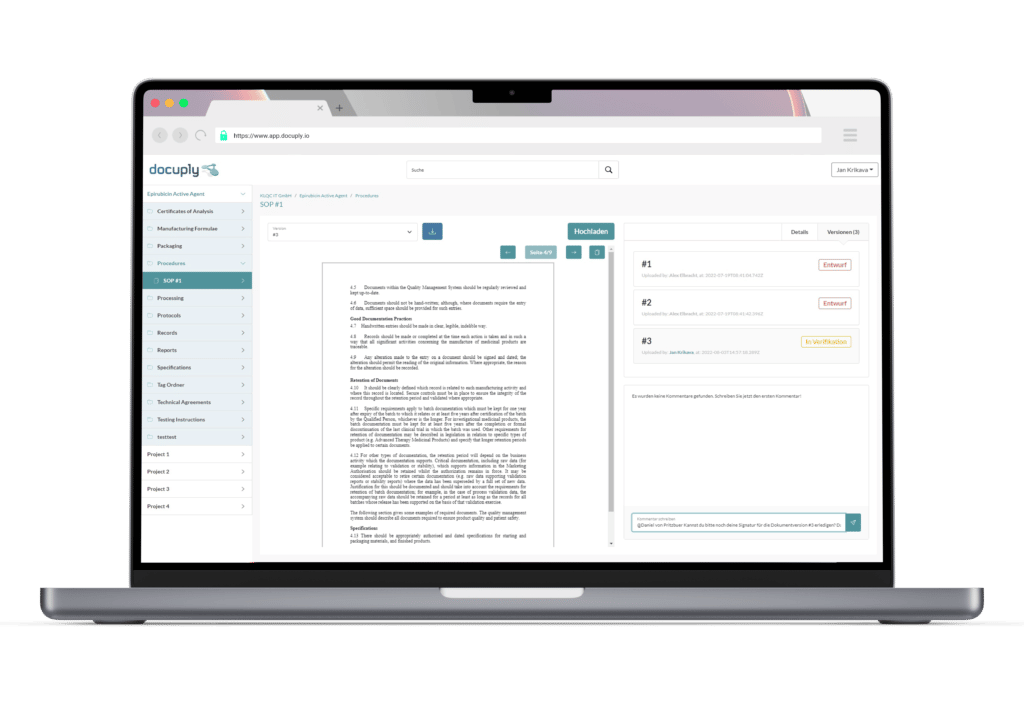
Mit Docuply kommen Sie mit Ihren Third Parties reibungslos und GLP-compliant von den präklinischen Studien in die klinischen Studien.
Schließlich ist Zeitmanagement ein wichtiger Aspekt des Pre-IND-Meetings. Das IND-Antragsverfahren kann mehrere Monate dauern, und es ist wichtig, im Voraus zu planen und ausreichend Zeit für jeden Schritt des Verfahrens einzuplanen. Dazu kann es gehören, realistische Zeitpläne und Meilensteine festzulegen und sicherzustellen, dass sich alle Teammitglieder ihrer Verantwortung bewusst sind.
Zusammenfassend lässt sich sagen, dass das Pre-IND-Meeting ein wesentlicher Schritt ist, um als Pharma- oder Biotech-Startup ein neues Medikament auf den Markt zu bringen. Wenn Sie gut vorbereitet sind, effektiv mit den Behörden kommunizieren, die Einhaltung der Vorschriften sicherstellen, die Finanzierung sichern und die Zeit effektiv nutzen, können Sie diesen Prozess erfolgreich durchlaufen und Ihr neues Arzneimittel in die klinischen Studien überführen.
Testen Sie jetzt unverbindlich alle Vorteile eines digitalen Dokumentenmanagementsystem, das speziell für die Pharma- und Biotechbranche entwickelt wurde. In nur fünf Minuten können Sie starten, überzeugen Sie sich selbst.
Qualitätsmanagement in der Pharma- und Biotechbranche: Aktuelle Herausforderungen bei der Zusammenarbeit zwischen Pharmaunternehmen und CROs, CMOs und CDMOs
