Umfassender Leitfaden für die Erstellung eines erfolgreichen Zulassungsantrags (MAA)

Wenn es darum geht, ein neues pharmazeutisches Produkt auf den Markt zu bringen, ist ein entscheidender Schritt die Einreichung eines Zulassungsantrags (Marketing Authorization Application, MAA). Dieser detaillierte Antrag, der auch als New Drug Application (NDA) bezeichnet wird, ist das Schlüsselelement für die Erteilung der Zulassung durch Behörden wie die FDA in den USA oder die EMA in Europa. In diesem Artikel gehen wir auf die wesentlichen Bestandteile eines Zulassungsantrags ein und zeigen, wie man sich in diesem komplizierten Prozess zurechtfindet.
Administrative Details: Das Fundament legen
Die Arbeit beginnt mit der Bereitstellung genauer administrativer Informationen. Geben Sie die Kontaktdaten des Antragstellers, der Mitantragsteller oder der Partner an. Ein gut formuliertes Anschreiben und ein umfassendes Inhaltsverzeichnis sind Ihre ersten Gelegenheiten, um bei den Zulassungsbehörden einen positiven Eindruck zu hinterlassen.
Zusammenfassung: Das Wesentliche auf den Punkt bringen
Erstellen Sie eine knappe, aber überzeugende Zusammenfassung des Antrags. Heben Sie die Vorteile des Produkts, die potenziellen Risiken und die beabsichtigte Verwendung oder Indikation hervor. Eine klare und prägnante Zusammenfassung gibt den Ton für den Rest des Antrags an.
Qualitätsdokumentation: Sicherstellung von Qualität
Die Regulierungsbehörden legen großen Wert auf die Qualität und Konsistenz des Arzneimittels. Die Formulierung, die Herstellungsverfahren und die strengen Qualitätskontrollen müssen detailliert beschrieben werden. Spezifikationen für Rohstoffe, Fertigprodukte und Verpackungsmaterialien sowie Stabilitätsdaten veranschaulichen die Haltbarkeit und Qualität des Produkts im Laufe der Zeit.
Präklinische Daten: Sicherheit geht vor
Belastbare präklinische Daten sind für den Nachweis der Produktsicherheit von zentraler Bedeutung. Legen Sie Ergebnisse aus Laborstudien und Tierversuchen vor, die Aufschluss über potenzielle Risiken geben. Decken Sie pharmakologische, toxikologische und ADME-Merkmale (Absorption, Verteilung, Metabolismus, Ausscheidung) umfassend ab.
Klinische Daten: Nachweis der Wirksamkeit und Sicherheit
Klinische Studien sind der Eckpfeiler eines jeden Zulassungsantrags. Präsentieren Sie detaillierte Ergebnisse aus diesen Studien, die die Sicherheit und Wirksamkeit des Produkts hervorheben. Fügen Sie Studienprotokolle, Broschüren der Prüfer und ausführliche klinische Studienberichte sowie demografische Daten der Patienten und statistische Analysen bei.
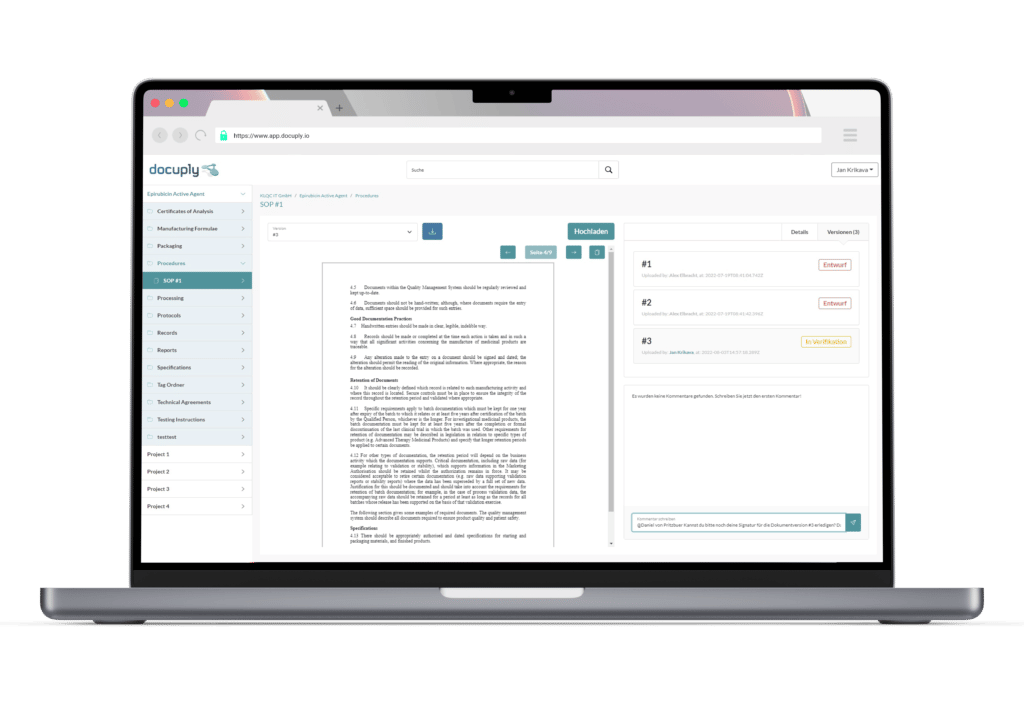
Die Datengrundlage für einen Zulassungsantrag benötigt ein strukturiertes Dokumentenmanagement im Rahmen des Qualitätsmanagements. Erfahren Sie jetzt, wie Ihnen Docuply hierbei hilft.
Pharmakovigilanz und Risikomanagement: Vorrang für die Sicherheit
Gehen Sie auf Strategien zur Überwachung der Produktsicherheit nach der Markteinführung ein. Erläutern Sie Pläne zum effektiven Management und zur Kommunikation potenzieller Risiken und zeigen Sie Ihr Engagement für die Patientensicherheit während des gesamten Lebenszyklus des Produkts.
Regulatorische Strategie: Durch das Labyrinth steuern
Ihre Zulassungsstrategie und -begründung spielen eine entscheidende Rolle. Erläutern Sie, wie Ihr Produkt mit den Sicherheits-, Wirksamkeits- und Qualitätsstandards in Einklang steht. Legen Sie eine solide wissenschaftliche Begründung für die vorgeschlagene Indikation und Dosierung vor.
Kennzeichnung und Verpackung: Das Erscheinungsbild Ihres Produkts
Achten Sie auf die vorgeschlagene Kennzeichnung, die die Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Gebrauchsanweisungen umfasst. Entwerfen Sie Verpackungsmaterialien, die sowohl funktional als auch optisch ansprechend sind.
Umweltrisikobewertung: Ein verantwortungsvoller Ansatz
Gehen Sie, falls zutreffend, auf mögliche Umweltauswirkungen ein. Heben Sie Ihr Engagement für umweltbewusste Praktiken hervor und unterstreichen Sie die Nachhaltigkeit Ihres Produkts.
Nutzungsgebühren und Zahlungen: Finanzielle Klarheit
Legen Sie transparent die Einzelheiten der mit Ihrem Antrag verbundenen Kosten dar. Die Demonstration von finanzieller Verantwortung erhöht Ihre Glaubwürdigkeit bei den Aufsichtsbehörden.
Fazit
Der Ablauf der Erstellung eines Zulassungsantrags kann kompliziert sein, aber eine sorgfältige und gut vorbereitete Einreichung erhöht Ihre Chancen auf eine Zulassung erheblich. Durch die sorgfältige Berücksichtigung aller Komponenten, von administrativen Details bis hin zu Umweltaspekten, schaffen Sie die Voraussetzungen für eine erfolgreiche Markteinführung Ihres pharmazeutischen Produkts. Die Zusammenarbeit mit Zulassungsexperten kann die Stärke Ihres Antrags und die Einhaltung der spezifischen Anforderungen der Behörden weiter verbessern.
Testen Sie jetzt unverbindlich alle Vorteile eines digitalen Dokumentenmanagementsystem, das speziell für die Pharma- und Biotechbranche entwickelt wurde. In nur fünf Minuten können Sie starten, überzeugen Sie sich selbst.
Qualitätsmanagement in der Pharma- und Biotechbranche: Aktuelle Herausforderungen bei der Zusammenarbeit zwischen Pharmaunternehmen und CROs, CMOs und CDMOs
