Die Bedeutung von Good Documentation Practice (GDP) in der pharmazeutischen Industrie

In der pharmazeutischen Industrie ist die Einhaltung von Good Documentation Practice (GDP) von entscheidender Bedeutung, um die Qualität, Sicherheit und Wirksamkeit von Arzneimitteln zu gewährleisten. GDP bezieht sich auf die genaue, konsistente und rechtzeitige Dokumentation aller Aspekte der Arzneimittelherstellung und -verteilung. Es ist eine grundlegende Voraussetzung, um die Integrität der Daten zu sichern, regulatorische Anforderungen zu erfüllen und die Patientensicherheit zu gewährleisten.
Warum ist GDP wichtig?
Die korrekte Dokumentation spielt eine zentrale Rolle bei der Überwachung und Kontrolle der Herstellungsprozesse. Sie ermöglicht die Rückverfolgbarkeit von Rohstoffen, den Herstellungsprozessen sowie der Verpackung und Lagerung von Arzneimitteln. Dies ist entscheidend, um Qualitätsabweichungen zu erkennen, zu beheben und um Rückrufaktionen zu koordinieren, falls erforderlich. Außerdem dient eine gründliche Dokumentation als Nachweis der Einhaltung von Vorschriften gegenüber den Aufsichtsbehörden.
Schlüsselprinzipien der GDP
Genauigkeit: Alle Informationen müssen präzise und korrekt erfasst werden. Fehler in der Dokumentation können zu Qualitätsproblemen führen und die Sicherheit der Patienten gefährden.
Lesbarkeit: Dokumente müssen klar und deutlich lesbar sein, um Missverständnisse zu vermeiden. Eine schlechte Lesbarkeit kann zu Fehlinterpretationen und falschen Entscheidungen führen.
Rückverfolgbarkeit: Es sollte möglich sein, jeden Schritt des Herstellungsprozesses und der Produktverteilung nachzuvollziehen. Dies ermöglicht eine schnelle Reaktion auf Qualitätsprobleme und eine effiziente Rückverfolgung im Falle von Rückrufen.
Zeitgerechte Dokumentation: Alle Informationen müssen in angemessener Zeit und unmittelbar nach dem Ereignis dokumentiert werden, um Echtzeitdaten zur Verfügung zu haben.
GDP in der Praxis
Die Einhaltung von GDP erfordert eine klare Dokumentationsrichtlinie und -verfahren, die von allen Mitarbeitern eingehalten werden müssen. Dies beinhaltet die Schulung des Personals, regelmäßige Überprüfungen von Dokumenten, die Verwendung genehmigter Vorlagen und die regelmäßige Aktualisierung von Aufzeichnungen.
Die Verwendung moderner Technologien und elektronischer Dokumentationssysteme hat die Effizienz der GDP verbessert. Diese Systeme ermöglichen eine präzise Datenerfassung, -speicherung und -verwaltung, reduzieren menschliche Fehler und erleichtern die Überprüfung durch Regulierungsbehörden.
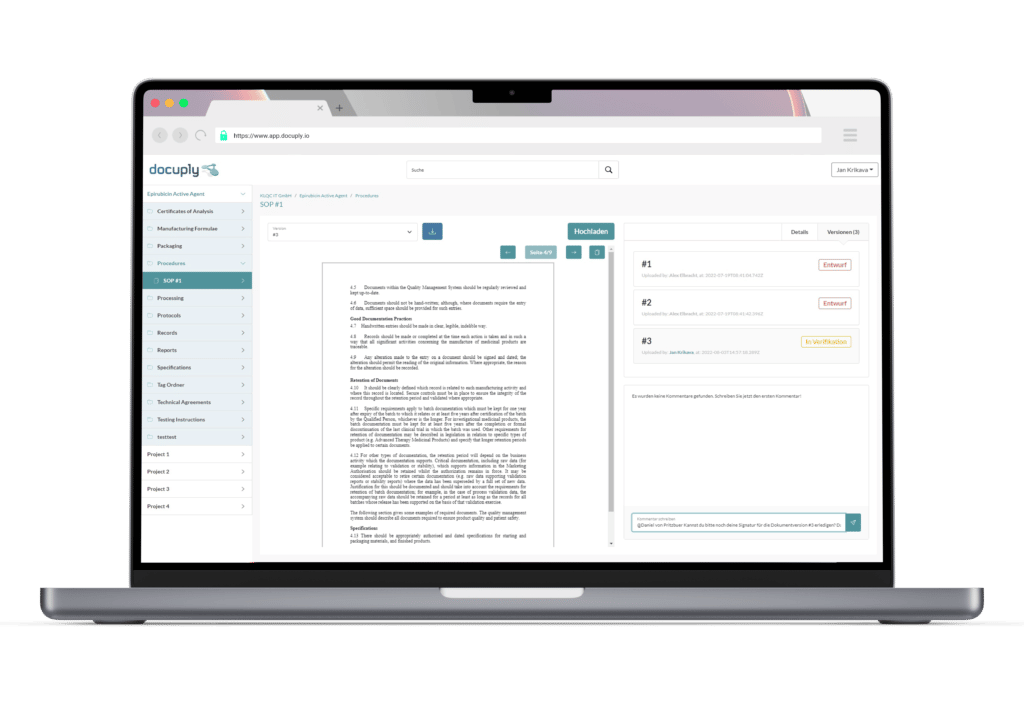
Mit Docuply die Good Documentation Practice einfach umsetzen und Ihr Dokumentenmanagement reibungslos gestalten.
Die Bedeutung von GDP für die Patientensicherheit
Letztendlich trägt die Einhaltung von GDP dazu bei, dass Patienten hochwertige und sichere Arzneimittel erhalten. Durch die genaue Dokumentation und Überwachung während des gesamten Herstellungs- und Vertriebsprozesses wird das Risiko von Verunreinigungen, Fälschungen oder anderen Qualitätsproblemen minimiert.
Fazit
Good Documentation Practice ist eine unerlässliche Säule in der pharmazeutischen Industrie. Sie gewährleistet nicht nur die Einhaltung von Vorschriften, sondern auch die Sicherheit und Qualität von Arzneimitteln. Eine umfassende und präzise Dokumentation ist daher entscheidend, um den Schutz der Patienten zu gewährleisten und das Vertrauen in die Pharmaunternehmen und deren Produkte zu stärken.
Hinweis: Dieser Artikel dient lediglich zu Informationszwecken und ersetzt nicht die professionelle Beratung im Zusammenhang mit GDP in der pharmazeutischen Industrie.
Testen Sie jetzt unverbindlich alle Vorteile eines digitalen Dokumentenmanagementsystem, das speziell für die Pharma- und Biotechbranche entwickelt wurde. In nur fünf Minuten können Sie starten, überzeugen Sie sich selbst.
Qualitätsmanagement in der Pharma- und Biotechbranche: Aktuelle Herausforderungen bei der Zusammenarbeit zwischen Pharmaunternehmen und CROs, CMOs und CDMOs
