Wir freuen uns, heute eine wichtige Neuerung bekannt zu geben: Unser bewährtes elektronisches Dokumentenmanagement steht ab sofort allen pharmazeutischen Start-ups kostenlos zur Verfügung. Als eQMS speziell für pharmazeutische KMU und Biotech-Start-Ups wissen wir, dass gerade in der Frühphase jeder Euro … Read More


Mannheimer Existenzgründungspreis MEXI: Docuply belegt den dritten Platz
Wir freuen uns sehr, beim 20-jährigen Jubiläum des Mannheimer Existenzgründungspreises (MEXI) mit dem dritten Platz ausgezeichnet worden zu sein. Diese Anerkennung bestärkt uns in unserem Vorhaben mit Docuply das digitale Qualitätsmanagementsystem für pharmazeutische KMU und Start-Ups zu entwickeln. Die Preisverleihung … Read More

Neues Whitepaper: Next Practices für die Inspection Readiness von Trial Master Files
Die stetige Weiterentwicklung klinischer Studien und die steigenden regulatorischen Anforderungen haben die Bedeutung eines effizienten Managements von Trial Master Files (TMF) in der pharmazeutischen Industrie erhöht. Insbesondere für Mitarbeiter in den Abteilungen Qualitätsmanagement und Regulatory Affairs ist die Inspection Readiness … Read More

Ihr Autopilot für Trial Master Files
Unsere Master Files Lösung für Trial Master Files ist jetzt online. Verknüpfen Sie nun unkompliziert Dokumente binnen Sekunden mit Ihrem Trial Master File. Jede neue Dokumentenversion des Dokuments wird automatisch mit dem Trial Master File synchronisiert. Das Ergebnis: Sie sind … Read More

Master Files – Der Autopilot für Trial Master Files, Drug Master Files und alle anderen Master Files
Nach reichlich Feedback unserer Kunden und Interessenten werden wir den Lösungsbaustein Master Files in den kommenden Wochen entwickeln. Mit Hilfe der Master Files Lösung können Sie Dokumente aus dem Dokumentenmanagement auf das gewünschte Master File, zum Beispiel TMF, DMF, SMF … Read More
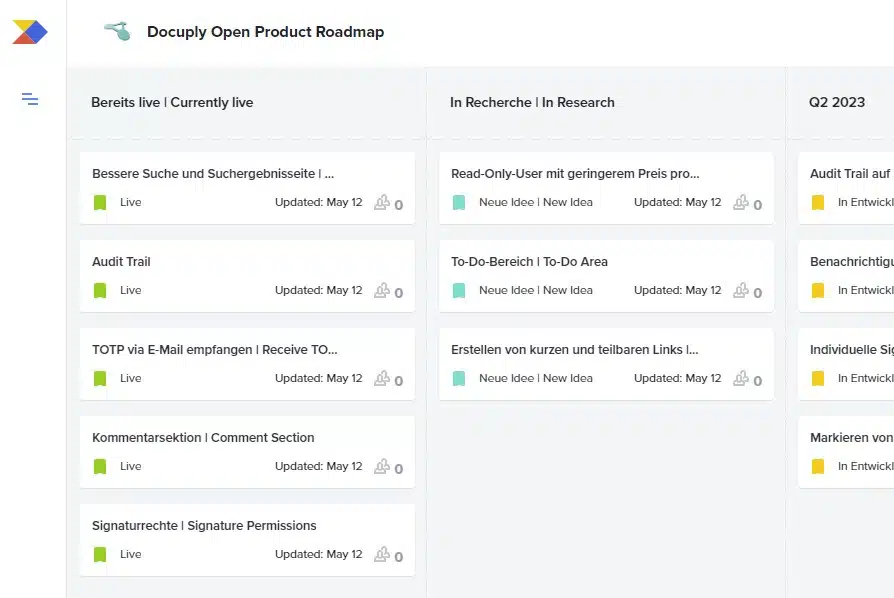
Unsere neue Open Product Roadmap ist da
Unsere neue Open Product Roadmap ist verfügbar und löst somit unsere alte Open Product Roadmap ab. Die neue Product Roadmap bietet den Vorteil einzelne Feature-Vorschläge zu bewerten. Hierzu muss man auf eine Feature-Karte klicken und anschließend die Bewertung vornehmen. Hierbei … Read More
Finden Sie Ihre Dokumente jetzt noch schneller und einfacher!
Wir haben uns das Feedback unserer Kunden zu Herzen genommen und unsere Suche überarbeitet. Das Ergebnis: Sie finden Dokumente jetzt noch schneller und einfacher! Zum einen konnten wir die Suchperformance weiter verbessern. Auch Tippfehler werden nun größtenteils im Hintergrund korrigiert, … Read More

Warum Docuply perfekt für Start-Ups ist
Wir haben die vergangenen Wochen intensiv genutzt, um weitere Biotech- und Pharmaunternehmen zu interviewen. Hierbei ist uns aufgefallen, dass gerade junge Start-Ups und kleine Contract Research Organizations (CRO – Auftragsforschungsunternehmen) vermehrt Interesse an Docuply zeigen. Das führt uns zur Frage, … Read More
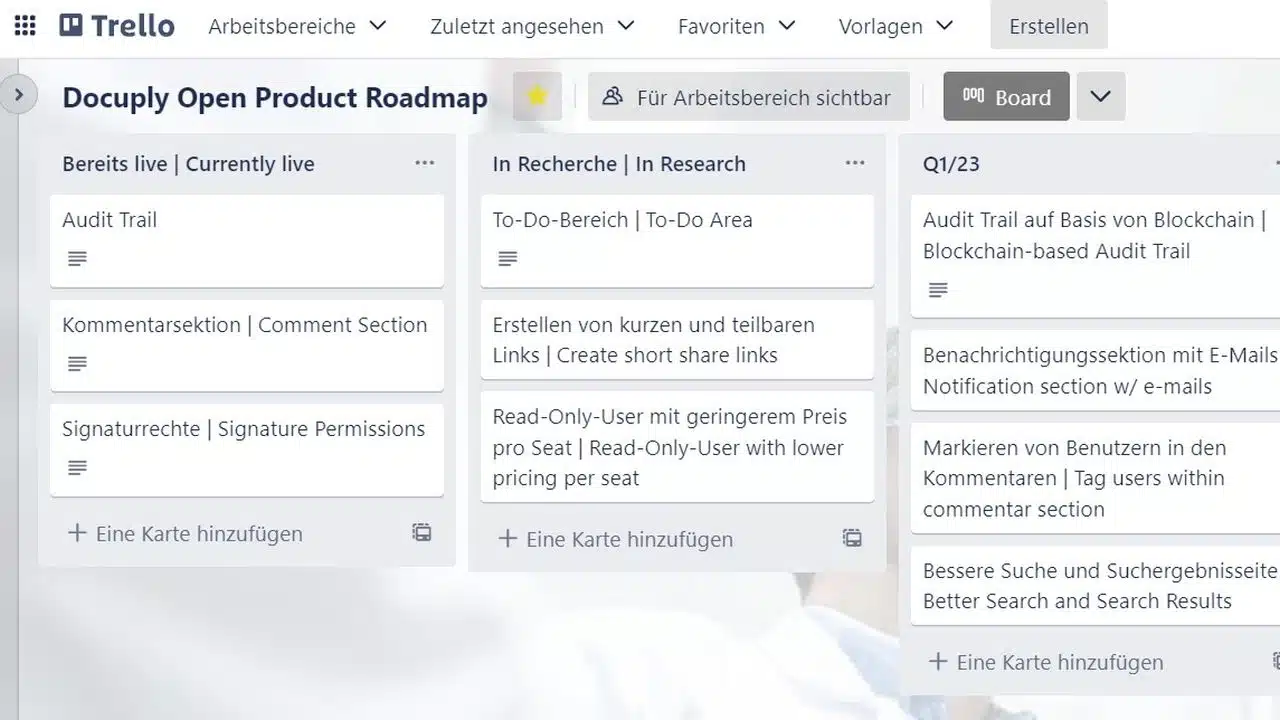
Unsere Open Product Roadmap
Als Startup ist es wichtig, dass man die Nutzer und ebenso Stakeholder abseits der Nutzer über die Zukunft des Produkts auf dem Laufenden hält. Eine Möglichkeit, dies zu tun, ist die Verwendung einer Open Product Roadmap. Eine Open Product Roadmap … Read More

Open Beta Phase Launch
In den vergangen acht Wochen haben wir dank Demopräsentationen und Evaluationsphasen mit ausgewählten Unternehmen das erste Feedback eingearbeitet. Wir freuen uns daher verkünden zu dürfen, dass wir nun auch für alle anderen Interessenten aus der Pharma- und Biotechbranche die Docuply-Registrierung … Read More